Ok, torniamo ai vecchi santi, visto che certe cose "raccontate" funzionano fino ad un certo punto (quindi mi spiace per chi troverà quel che segue incomprensibile)...
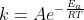
Per chi non la riconosce è l'equazione di Arrehnius, dove k è la costante cinetica, A il fattore preesponenziale, Ea l'energia di attivazione, R la costante dei gas e T la temperatura in Kelvin.
Cosa ci dice questa equazione? Che la costante cinetica diminuisce con Ea e aumenta con la temperatura. L'equazione di Arrehnius era un'equazione empirica, ma già si dovrebbe orecchiare che se si parla di un'energia anche trattando di un costante cinetica c'è un aggancio a qualcosa di altro, e infatti nei decenni successivi si lavorò per provare a rielaborarla dando un significato termodinamico ai suoi termini.
La Teoria dello Stato di Transizione, o del complesso attivato, è ben descritta nei suoi tratti salienti dall'immagine: tra reagenti e prodotti di reazione c'è uno stato intermedio a più alta energia libera rispetto ai reagenti, il complesso attivato, con cui i reagenti sono in equilibrio; per avere reazione si deve fornire quella quantità di energia, ΔG‡. ΔGr, quello associato alla reazione, nell'immagine è rappresentato dalla differenza tra il "livello" dei reagenti e quello dei prodotti.
Per questa strada si arriva all'equazione di Eyring-Polanyi (1935)
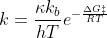
dove
k continua ad essere la costante cinetica, κ il coefficiente di
trasmissione, kb la costante di Boltzmann, h la costante di Planck, ΔG‡
l'energia libera di Gibbs di attivazione, R la costante dei gas e T la
temperatura in Kelvin. Quindi la costante cinetica è funzione anche del
valore di una funzione di stato della termodinamica, un'energia libera
di Gibbs, appunto.
Prendiamo in esame
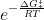
a qualcuno magari ricorda qualcosa...
Sappiamo che per la costante di equilibrio K per una reazione
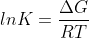
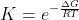
Quindi:
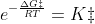
Si tratta della costante di equilibrio per la reazione reagenti ⇄ complesso attivato, e possiamo riscrivere l'equazione di Eyring-Polanyi come
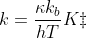
La costante cinetica è direttamente proporzionale a una costante di equilibrio.
ref.: "Chemical Kinetics and Reaction Dynamics", Santosh K. Upadhyay, 2006 (Springer)


Nessun commento:
Posta un commento
Nota. Solo i membri di questo blog possono postare un commento.